12:17
[익명]
화학요 이거 어떻게 풀어요? ㅠㅠㅠ
이거 어떻게 풀어요? ㅠㅠㅠ
바닥 상태인 나트륨 원자의 전자 배치는 1s²2s²2p⁶3s¹입니다. (가)는 구형이므로 s오비탈임을 알 수 있고, (나)와 (다)는 아령 모양이므로 p오비탈입니다. (가) 오비탈의 에너지 준위가 가장 높다고 했으니 (가)가 3s오비탈에 해당하며, (나)와 (다)는 2p오비탈에 해당합니다.
① (가)에 전자 1개가 들어있으므로 맞습니다.
② (나)와 (다)는 모양만 다를뿐이지 에너지 준위는 같으므로 맞습니다.
③ (가)는 3s, (나)와 (다)가 2p이므로 주양자수는 (가)가 3, (다)가 2이므로 (가)>(다)입니다. 맞습니다.
④ p오비탈의 부 양자수는 1이며 (나)와 (다) 모두 p오비탈이므로 같은 부 양자수를 갖습니다. 맞습니다.
⑤ 자기 양자수는 부 양자수에 (-) 또는 (+) 부호를 붙인 범위의 값을 갖는데, (가)의 부 양자수는 0이고, (나), (다)는 -1, 0, +1 셋 중 어느 하나입니다. 구체적으로 말씀드리자면 p오비탈중 x축 방향이 -1, y축 방향이 0, z축 방향이 +1이라고 정의하므로 (가) = (나) ≠ (다)이기에 틀립니다.
따라서 답은 ⑤입니다.
회원가입 혹은 광고 [X]를 누르면 내용이 보입니다
-
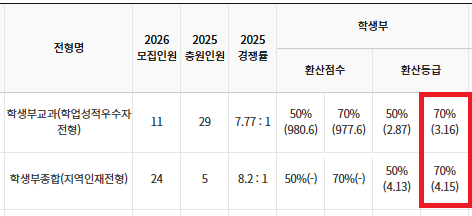
창원대 수시 .. 창원대를 목표로 하고 있는 09년생입니다 지금 제 내신이 5등급제 기준으로
2025.12.01 -
목포에서 롯데월드 가는 법 목포 버스 터미널에서 롯데월드로 갈 수 있는 경로 알려주세요
2025.12.01 -
애니?리뷰 유튜버 찾아주세요ㅠㅠ 무슨 검정머리 남자 캐릭터에 더빙하신분도 남자였던거같은데기승전결로 나눠서 기. 하고 설명하고
2025.12.01 -

발로란트 제한뜨는데 어떻게 해야하나요? 친구가 발로란트 한번해보자고 계정 빌려줬는데 제한이라고 접속이 안되는데 어떻게 해야하나요?
2025.12.01 -

KTX 12월31일 예매 수원이나 서울에서 부산으로 가는 열차를 예매하려고 하는데 언제 열리나요 오늘
2025.12.01 -

한국 지금 쉬었음청년40만명이라는데 4년대학졸업생이 많다던데요 쉬었음청년이 40만명인데 문제가 무엇인가요?
2025.12.01